Hogyan növeli meg a kalória-csökkentés az élettartamot?
A kalória-csökkentés azt jelenti, hogy korlátozzuk a naponta elfogyasztott kalória mennyiségét anélkül, hogy alultápláltság lépne fel. A kalória-csökkentés többféle szervezetben is az élettartam megnövekedését, illetve az időskori krónikus betegségek előfordulásának csökkenését eredményezi.(2,3) Ez a hatás többféle állatfaj esetében is kimutatható, beleértve az emlősöket is.
Amikor kevés kalóriát viszünk be - böjtölés során -, a sejtek védekező, javító üzemmódba kapcsolnak. Olyan folyamatok indulnak be, melyek során a sejtek megújulnak, és ezáltal hatékonyabban tudnak védekezni a káros behatások ellen. Ezek a változások hosszútávon is kedvezően befolyásolják az egészséget, és akár még az élettartam megnövekedését is eredményezhetik.
A modern, "nyugati típusú" társadalmakra ugyanakkor az jellemző, hogy az emberek túlzott táplálék-bevitellel mérgezik magukat. Ez a krónikus kalóriatöbblet egy sor egészségügyi problémához vezet. Az elhízás, a 2-es típusú cukorbetegség, metabolikus szindróma, különböző neurodegeneratív betegségek és a rák mind olyan betegségek, melyek összefüggésbe hozhatóak a túlzott kalóriabevitellel.

Az utóbbi években sikerült azonosítani több olyan konkrét sejtszintű változást, melyet a kalóriabevitel korlátozásával elérhetünk (4-10). Ezek közül a következők tekinthetőek a legfontosabbnak:
- A szirtuinek (a sejtek egészségét biztosító fehérjék) működésének serkentése
- Az mTOR aktvitásának csökkentése (ez a fehérje az öregedéshez és a krónikus betegségek kialakulásához köthető)
- A sejtek elöregedésének lassítása, valamint
- Az autofágiának (a sejtek "nagytakarításának") a segítése
- Az AMPK ( egy anyagcserét szabályozó enzim) működésének serkentése
Ezek a folyamatok a krónikus betegségek számos változatától, illetve az öregedés felgyorsulásától is megóvják a szervezetet. (4,6-10)
- A kalóriacsökkentés és az időszakos böjtölés "utánzói"
Egy korlátozó diéta betartása nehéz dolog, és sokaknak kellemetlen is lehet. Vannak, akik számára a jelentős mértékű kalória-csökkentés olyan mellékhatásokkal jár, mint az energiaszint, a libidó vagy a csontsűrűség csökkenése, de kialakulhat depresszió is vagy egyéb kellemetlen következmény.(1)
A kutatások szerencsére egyre inkább arra utalnak, hogy a kemény diétának vannak alternatívái. Többféle vegyületről is kimutatták, hogy ugyanazokra a sejtpályákra hatnak, melyekre a kalóriacsökkentés, ugyanakkor nem járnak mellékhatásokkal.
Ezeket a vegyületeket a kalória-csökkentés mimetikusának aza utánzóinak nevezik. A kalóriacsökkentés mimetikusának tekinthetők például az egészségjavító polifenolok. A kalória-csökkentés esetében a tudomány mára mind az öt fent vázolt pozitív, sejtszintű változás esetében azonosított mimetikusokat, melyek ugyanazt a hatást képesek elérni.
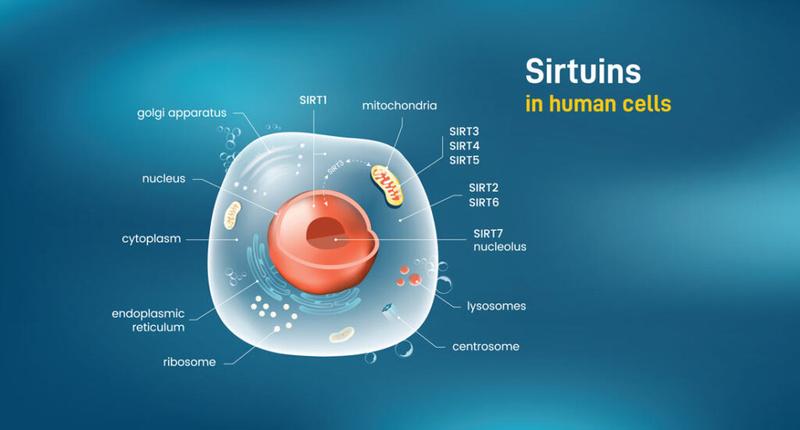
- A szirtuin működés serkentése
Az egyik fontos hatás, melyen keresztül a kalóriabevitel csökkentése megnöveli élettartamot, a szirtuin nevű jelzőfehérjék (ezen belül is elsősorban a SIRT1) aktivitásának a facilitálása. (6-8) A szirtuinok szabályozzák a sejtek egészségét, illetve megvédik a sejtek komponenseit a káros behatásoktól. Megóvják a DNS-t az olyan hatásoktól, melyek felgyorsítanák az öregedési folyamatokat vagy kedveznének a betegségek kialakulásának.(12,13)
A kutatások azt mutatják, hogy a szirtuin funkciók javításával többféle szervezet esetében is megnövelhető az élettartam. (12,14-18) A rezveratrol nevű polifenol, mely megtalálható a vörösborban, szőlőben, és különböző bogyós gyümölcsökben, aktiválja a SIRT1-et. (14-16,19,20). Egerekben a rezveratrol hozzájárul a diétához hasonló folyamatok beindításához, melyek lassítják az öregedést (11). A rezveratrolról továbbá kimutatták, hogy az élesztőgombákban stabilizálja a DNS-t és 70 %-kal növeli az élettartamot. (19)
Noha a rezveratrol aktiválja a szirtuin funkciókat, egy másik elemre, az úgynevezett NAD+-ra (nikotinamid adenin dinukleotid) is szükség van ahhoz, hogy a szirtuinok megfelelően működjenek. Az életkor előrehaladtál a NAD+ szintje azonban csökken. (12,13) A szájon át szedhető NAD+ prekurzor, a nicotinamide riboside, gyorsan növeli a sejtekben a NAD+ szintjét, ezzel segítve az egészséges szirtuin működést. (21-23).
A rezveratrol és a nicotinamide riboside együttesen biztosítja leginkább a sejtek hosszú távú egészségét.
- Az mTOR aktivitás csökkentése
Fiatal egyedeknél a kiegyensúlyozott mTOR aktivitás teszi lehetővé a gyors növekedést. Azonban ha az mTOR aktivitás turbó üzemmódban marad idősebb életkorban is, számos káros hatás léphet fel. Amikor magas a tápanyagbevitel, az mTOR aktivitás megnő. Ha az mTOR szint nincs egyensúlyban, az idősödő egyénben nem kívánatos zsírraktár halmozódhat fel, még akkor is, ha egyébként nem visz be túl sok kalóriát. A kalória-megvonás csökkenti az mTOR aktivitását, ezzel is védve az egészséget. (8) A kutatások azt mutatják, hogy a rezveratrol és a kurkumin mTOR-gátló hatással rendelkezik (38-42).
- A sejtek elöregedésének megakadályozása
A sejtek öregszenek, sok közülük idővel diszfunkcionálissá válik, és elveszíti a növekedésre vagy osztódásra való képességét. Ezt a folyamatot hívják sejt-öregedésnek. Az elöregedett sejtek olyan vegyületeket választanak ki, melyek ártalmasak a környező sejtekre, és gyulladáshoz vezetnek. Nagyrészt a sejt-öregedés áll a szövetek elöregedése, a funkcióvesztés és a betegségek kialakulása mögött. A kalória-csökkentéssel lassul a sejtek öregedése, ezáltal a környező szövetek is védettebbé válnak a káros behatásoktól. (6) A szenolitikumoknak nevezett vegyületek segíthetnek az elöregedett sejtek által okozott károk mérséklésében kalória-megvonás nélkül is.
A kutatók találtak egy módszert az elöregedett sejtek számának csökkentésére, melynek során olyan növényi tápanyagokat használnak fel, melyek megtalálhatók közkedvelt ételekben és italokban is. A kvercetin önmagában is rendelkezik szenolitikus tulajdonságokkal (53), a feketeteában található theaflavinok pedig hasonló sejtek közti jelző funkciókat látnak el (54-56).
Nemrégiben a kutatók újabb áttörést értek el a szenolitikus terápiában. Rájöttek ugyanis, hogy az apigenin (ami egy növényi vegyület) képes semlegesíteni azokat a káros vegyületeket, melyeket az elöregedett sejtek bocsátanak ki (57,58). A könnyen felszívódó kvercetin, valamint a theaflavin és az apigenin kombinációjával a tudósok egy olyan recept nélkül kapható, növényi alapú szert hoztak létre, amely anélkül vált ki szenolitikus hatást, hogy gyógyszerkészítményekhez kellene folyamodni.

- Az autofágia serkentése
Ahogy a sejtek öregszenek, a sérült és elhasznált összetevőik felhalmozódnak a szervezetben, ami megakadályozza a sejtek normális működését. A korai életszakaszokban a sejtek rendszeresen végeznek egyfajta "nagytakarítást". Ennek keretében megszabadulnak a sejtek belsejében felhalmozódó öregebb, sérült alkotóelemektől, és azokat új, egészséges komponensekre cserélik. Ezt a folyamatot nevezzük autofágiának. Az életkor előrehaladtával, illetve a nem megfelelő táplálkozás következményeként, az autofágia hanyatlásnak indul és az elhasznált sejtkomponensek felhalmozódnak a szervezetben, ami miatt a szövetekben a sejtfunkciók sem működnek megfelelően. Az elégtelen autofágia nagyban hozzájárul az időskori betegségek kialakulásához (59). A kalória-csökkentésről kimutatták, hogy képes az autofágiát stimulálni, ezzel felfrissítve és megfiatalítva a sejteket. (4)
Több növényi-eredetű tápanyagról, többek között a rezveratrolról és a kurkuminról is kimutatták, hogy hasonlóan hozzájárul az egészséges autofágia megőrzéséhez. (59-63). A kutatások arra is utalnak, hogy ez védelmet jelenthet a rákkal, az Alzheimer kórhoz hasonló neurodegeneratív megbetegedésekkel, illetve más krónikus betegségekkel szemben is. (59-63)
- Összefoglalás
A kalória-csökkentésen alapuló diéta az egyik legintenzívebben kutatott módszer a betegségek megelőzésére, illetve az élettartam kiterjesztésére. Azonban a szigorú diéták követése a legtöbb ember számára nehéznek, vagy akár lehetetlennek is bizonyulhat. A tudósok azonosítottak olyan sejtszintű folyamatokat, melyeket a kalóriabevitel korlátozásával járó diéták kedvezően befolyásolnak. Számos növényi-alapú tápanyagról mutatták ki, hogy hasonló hatással rendelkeznek, mint a tápanyagbevitelt korlátozó diéták.
- A rezveratrol és a nicotinamide riboside hozzájárul az egészséges szirtuin funkciók fenntartásához.
- A rezveratrol és a kurkuma csökkenti az mTOR nevű fehérje káros aktivitását, miközben serkentik az autofágiát vagy a sejtek "nagytakarítását".
- A theaflavinok és a könnyen felszívódó kvercetin csökkentik az elöregedett, diszfunckionális sejtek számát a szövetekben. Az apigenin pedig azoknak a káros anyagoknak a koncentrációját csökkenti, melyeket az elöregedett sejtek bocsátanak ki.
- Ezek a tápanyagok tehát hasonló élethossz-növelő hatást produkálnak, mint a kalória-megvonás.
Forrás: Nancy Kovacs: Nutrients that Provide Benefits of Caloric Restriction
Hivatkozások:
- Dirks AJ, Leeuwenburgh C. Caloric restriction in humans: potential pitfalls and health concerns. Mech Ageing Dev. 2006 Jan;127(1):1-7.
- Anton S, Leeuwenburgh C. Fasting or caloric restriction for healthy aging. Exp Gerontol. 2013 Oct;48(10):1003-5.
- Golbidi S, Daiber A, Korac B, et al. Health Benefits of Fasting and Caloric Restriction. Curr Diab Rep. 2017 Oct 23;17(12):123.
- Bergamini E, Cavallini G, Donati A, et al. The role of autophagy in aging: its essential part in the anti-aging mechanism of caloric restriction. Ann N Y Acad Sci. 2007 Oct;1114:69-78.
- Calvert S, Tacutu R, Sharifi S, et al. A network pharmacology approach reveals new candidate caloric restriction mimetics in C. elegans. Aging Cell. 2016 Apr;15(2):256-66.
- Fontana L, Nehme J, Demaria M. Caloric restriction and cellular senescence. Mech Ageing Dev. 2018 Dec;176:19-23.
- Lee SH, Min KJ. Caloric restriction and its mimetics. BMB Rep. 2013 Apr;46(4):181-7.
- Madeo F, Carmona-Gutierrez D, Hofer SJ, et al. Caloric Restriction Mimetics against Age-Associated Disease: Targets, Mechanisms, and Therapeutic Potential. Cell Metab. 2019 Mar 5;29(3):592-610.
- Roth GS, Ingram DK. Manipulation of health span and function by dietary caloric restriction mimetics. Ann N Y Acad Sci. 2016 Jan;1363:5-10.
- Ungvari Z, Parrado-Fernandez C, Csiszar A, et al. Mechanisms underlying caloric restriction and lifespan regulation: implications for vascular aging. Circ Res. 2008 Mar 14;102(5):519-28.
- Pearson KJ, Baur JA, Lewis KN, et al. Resveratrol delays age-related deterioration and mimics transcriptional aspects of dietary restriction without extending life span. Cell Metab. 2008 Aug;8(2):157-68.
- Imai S, Guarente L. NAD+ and sirtuins in aging and disease. Trends Cell Biol. 2014 Aug;24(8):464-71.
- Johnson S, Imai SI. NAD (+) biosynthesis, aging, and disease. F1000Res. 2018;7:132.
- Cao MM, Lu X, Liu GD, et al. Resveratrol attenuates type 2 diabetes mellitus by mediating mitochondrial biogenesis and lipid metabolism via Sirtuin type 1. Exp Ther Med. 2018 Jan;15(1):576-84.
- Cao W, Dou Y, Li A. Resveratrol Boosts Cognitive Function by Targeting SIRT1. Neurochem Res. 2018 Sep;43(9):1705-13.
- Deng Z, Li Y, Liu H, et al. The role of sirtuin 1 and its activator, resveratrol in osteoarthritis. Biosci Rep. 2019 May 31;39(5).
- Belenky P, Racette FG, Bogan KL, et al. Nicotinamide riboside promotes Sir2 silencing and extends lifespan via Nrk and Urh1/Pnp1/Meu1 pathways to NAD+. Cell. 2007 May 4;129(3):473-84.
- Zhang H, Ryu D, Wu Y, et al. NAD(+) repletion improves mitochondrial and stem cell function and enhances life span in mice. Science. 2016 Jun 17;352(6292):1436-43.
- Alcain FJ, Villalba JM. Sirtuin activators. Expert Opin Ther Pat. 2009 Apr;19(4):403-14.
- 20. Kaeberlein M, McDonagh T, Heltweg B, et al. Substrate-specific activation of sirtuins by resveratrol. J Biol Chem. 2005 Apr 29;280(17):17038-45.
- Martens CR, Denman BA, Mazzo MR, et al. Chronic nicotinamide riboside supplementation is well-tolerated and elevates NAD(+) in healthy middle-aged and older adults. Nat Commun. 2018 Mar 29;9(1):1286.
- Trammell SA, Schmidt MS, Weidemann BJ, et al. Nicotinamide riboside is uniquely and orally bioavailable in mice and humans. Nat Commun. 2016 Oct 10;7:12948.
- Yang T, Chan NY, Sauve AA. Syntheses of nicotinamide riboside and derivatives: effective agents for increasing nicotinamide adenine dinucleotide concentrations in mammalian cells. J Med Chem. 2007 Dec 27;50(26):6458-61.
- Lyons CL, Roche HM. Nutritional Modulation of AMPK-Impact upon Metabolic-Inflammation. Int J Mol Sci. 2018 Oct 9;19(10).
- Ruderman NB, Carling D, Prentki M, et al. AMPK, insulin resistance, and the metabolic syndrome. J Clin Invest. 2013 Jul;123(7):2764-72.
- Salminen A, Kaarniranta K. AMP-activated protein kinase (AMPK) controls the aging process via an integrated signaling network. Ageing Res Rev. 2012 Apr;11(2):230-41.
- Towler MC, Hardie DG. AMP-activated protein kinase in metabolic control and insulin signaling. Circ Res. 2007 Feb 16;100(3):328-41.
- Gauhar R, Hwang SL, Jeong SS, et al. Heat-processed Gynostemma pentaphyllum extract improves obesity in ob/ob mice by activating AMP-activated protein kinase. Biotechnol Lett. 2012 Sep;34(9):1607-16.
- Nguyen PH, Gauhar R, Hwang SL, et al. New dammarane-type glucosides as potential activators of AMP-activated protein kinase (AMPK) from Gynostemma pentaphyllum. Bioorg Med Chem. 2011 Nov 1;19(21):6254-60.
- Park SH, Huh TL, Kim SY, et al. Antiobesity effect of Gynostemma pentaphyllum extract (actiponin): a randomized, double-blind, placebo-controlled trial. Obesity (Silver Spring). 2014 Jan;22(1):63-71.
- Wang J, Ha TKQ, Shi YP, et al. Hypoglycemic triterpenes from Gynostemma pentaphyllum. Phytochemistry. 2018 Nov;155:171-81.
- Dong C, Xie Z, Yu Y, et al. Discovery, synthesis, and structure-activity relationships of 20S-dammar-24-en-2alpha,3beta,12beta,20-tetrol (GP) derivatives as a new class of AMPKalpha2beta1gamma1 activators. Bioorg Med Chem. 2016 Jun 15;24(12):2688-96.
- Lee HS, Lim SM, Jung JI, et al. Gynostemma Pentaphyllum Extract Ameliorates High-Fat Diet-Induced Obesity in C57BL/6N Mice by Upregulating SIRT1. Nutrients. 2019 Oct 15;11(10).
- Ohara T, Muroyama K, Yamamoto Y, et al. Oral intake of a combination of glucosyl hesperidin and caffeine elicits an anti-obesity effect in healthy, moderately obese subjects: a randomized double-blind placebo-controlled trial. Nutr J. 2016 Jan 19;15:6.
- Pu P. [Protection mechanisms of hesperidin on mouse with insulin resistance]. Zhongguo Zhong Yao Za Zhi. 2016 Sep;41(17):3290-5.
- Rizza S, Muniyappa R, Iantorno M, et al. Citrus polyphenol hesperidin stimulates production of nitric oxide in endothelial cells while improving endothelial function and reducing inflammatory markers in patients with metabolic syndrome. J Clin Endocrinol Metab. 2011 May;96(5):E782-92.
- Xiong H, Wang J, Ran Q, et al. Hesperidin: A Therapeutic Agent For Obesity. Drug Des Devel Ther. 2019;13:3855-66.
- Beevers CS, Chen L, Liu L, et al. Curcumin disrupts the Mammalian target of rapamycin-raptor complex. Cancer Res. 2009 Feb 1;69(3):1000-8.
- Kuo CJ, Huang CC, Chou SY, et al. Potential therapeutic effect of curcumin, a natural mTOR inhibitor, in tuberous sclerosis complex. Phytomedicine. 2019 Feb 15;54:132-9.
- Liu M, Wilk SA, Wang A, et al. Resveratrol inhibits mTOR signaling by promoting the interaction between mTOR and DEPTOR. J Biol Chem. 2010 Nov 19;285(47):36387-94.
- Zhou H, Luo Y, Huang S. Updates of mTOR inhibitors. Anticancer Agents Med Chem. 2010 Sep;10(7):571-81.
- Huang S. Inhibition of PI3K/Akt/mTOR signaling by natural products. Anticancer Agents Med Chem. 2013 Sep;13(7):967-70.
- Den Hartogh DJ, Gabriel A, Tsiani E. Antidiabetic Properties of Curcumin II: Evidence from In Vivo Studies. Nutrients. 2019 Dec 25;12(1).
- Den Hartogh DJ, Gabriel A, Tsiani E. Antidiabetic Properties of Curcumin I: Evidence from In Vitro Studies. Nutrients. 2020 Jan 1;12(1).
- Lu X, Wu F, Jiang M, et al. Curcumin ameliorates gestational diabetes in mice partly through activating AMPK. Pharm Biol. 2019 Dec;57(1):250-4.
- Repossi G, Das UN, Eynard AR. Molecular Basis of the Beneficial Actions of Resveratrol. Arch Med Res. 2020 Feb;51(2):105-14.
- Song J, Huang Y, Zheng W, et al. Resveratrol reduces intracellular reactive oxygen species levels by inducing autophagy through the AMPK-mTOR pathway. Front Med. 2018 Dec;12(6):697-706.
- Hickson LJ, Langhi Prata LGP, Bobart SA, et al. Senolytics decrease senescent cells in humans: Preliminary report from a clinical trial of Dasatinib plus Quercetin in individuals with diabetic kidney disease. EBioMedicine. 2019 Sep;47:446-56.
- Palmer AK, Xu M, Zhu Y, et al. Targeting senescent cells alleviates obesity-induced metabolic dysfunction. Aging Cell. 2019 Jun;18(3):e12950.
- Zhang P, Kishimoto Y, Grammatikakis I, et al. Senolytic therapy alleviates Abeta-associated oligodendrocyte progenitor cell senescence and cognitive deficits in an Alzheimer's disease model. Nat Neurosci. 2019 May;22(5):719-28.
- Zhu Y, Tchkonia T, Pirtskhalava T, et al. The Achilles' heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell. 2015 Aug;14(4):644-58.
- Justice JN, Nambiar AM, Tchkonia T, et al. Senolytics in idiopathic pulmonary fibrosis: Results from a first-in-human, open-label, pilot study. EBioMedicine. 2019 Feb;40:554-63.
- Kim SR, Jiang K, Ogrodnik M, et al. Increased renal cellular senescence in murine high-fat diet: effect of the senolytic drug quercetin. Transl Res. 2019 Nov;213:112-23.
- Han X, Zhang J, Xue X, et al. Theaflavin ameliorates ionizing radiation-induced hematopoietic injury via the NRF2 pathway. Free Radic Biol Med. 2017 Dec;113:59-70.
- Noberini R, Koolpe M, Lamberto I, et al. Inhibition of Eph receptor-ephrin ligand interaction by tea polyphenols. Pharmacol Res. 2012 Oct;66(4):363-73.
- Noberini R, Lamberto I, Pasquale EB. Targeting Eph receptors with peptides and small molecules: progress and challenges. Semin Cell Dev Biol. 2012 Feb;23(1):51-7.
- Lim H, Park H, Kim HP. Effects of flavonoids on senescence-associated secretory phenotype formation from bleomycin-induced senescence in BJ fibroblasts. Biochem Pharmacol. 2015 Aug 15;96(4):337-48.
- Perrott KM, Wiley CD, Desprez PY, et al. Apigenin suppresses the senescence-associated secretory phenotype and paracrine effects on breast cancer cells. Geroscience. 2017 Apr;39(2):161-73.
- Forouzanfar F, Read MI, Barreto GE, et al. Neuroprotective effects of curcumin through autophagy modulation. IUBMB Life. 2020 Apr;72(4):652-64.
- Deng S, Shanmugam MK, Kumar AP, et al. Targeting autophagy using natural compounds for cancer prevention and therapy. Cancer. 2019 Apr 15;125(8):1228-46.
- Kou X, Chen N. Resveratrol as a Natural Autophagy Regulator for Prevention and Treatment of Alzheimer's Disease. Nutrients. 2017 Aug 24;9(9).
- Lin KL, Lin KJ, Wang PW, et al. Resveratrol provides neuroprotective effects through modulation of mitochondrial dynamics and ERK1/2 regulated autophagy. Free Radic Res. 2018 Dec;52(11-12):1371-86.
- Perrone L, Squillaro T, Napolitano F, et al. The Autophagy Signaling Pathway: A Potential Multifunctional Therapeutic Target of Curcumin in Neurological and Neuromuscular Diseases. Nutrients. 2019 Aug 13;11(8).





